globna hrskavica je tkivo koje povezuje susjedne kosti u zglobu, omogućujući tako glatke kretnje bez trenja u svrhu pokretljivosti zglobova. Oštećenje hrskavice i njezin gubitak dovode do boli, krutosti i smanjenog opsega kretnji u zahvaćenim zglobovima. Mikrofraktura je oblik kirurškog liječenja koju je predstavio dr. Steadman 1980-ih a temelji se na stimulaciji tkiva, tako da svojim vlastitim procesom zacjeljivanja popravi nastala oštećenja (5). To uključuje kirurško formiranje malih rupa tj. mikrofraktura u subhondralnoj kosti ispod oštećenog dijela, čime je omogućeno koštanoj srži i krvi da prekriju zahvaćeno mjesto i formiraju krvni ugrušak. S vremenom, ugrušak fibrozira stvarajući tako fibroznu hrskavicu koja ispunjava područje zahvaćeno defektom i vraća glatku površinu hrskavice. Tom tehnikom se također izaziva koštano cijeljenje s ciljem da hrskavična faza koštanog cijeljenja zaostane u hrskavičnom mikrookolišu. Mikrofrakture su posljednjih godina dobile na popularnosti kao minimalno invazivna procedura u odnosu na kompleksne kirurške metode kao što su autologna implantacija hondrocita (eng. Autologous Chondrocyte Implantation ACI) ili koštano-hrskavični transplantat (6). Koriste se u liječenju manjih do srednje teških oštećenja zglobova koji su pod većim opterećenjem, poput kuka, koljena i gležnja. Zahvat se u pravilu izvodi endoskopskom tehnikom, artroskopijom, što omogućuje kraće vrijeme oporavka i manji rizik od komplikacija u odnosu na tradicionalne otvorene operacije. Iako kirurški pristup uporabom tehnike mikrofraktura ima obećavajuće rezultate u smislu smanjenja boli i bolje pokretljivosti, i dalje postoje neka ograničenja ovih zahvata. Fibrozna hrskavica koja se formira nije dovoljno izdržljiva i kraćeg je vijeka od hijaline hrskavice, a postoji i rizik od dodatnog oštećenja hrskavice samim zahvatom. Nadalje, nisu svi pacijenti podobni kandidati za ovaj zahvat te uspjeh operacije ovisi o raznim faktorima kao što su veličina i lokacija defekta, dob i razina aktivnosti pacijenta te eventualno postojanje neke druge patologije zglobova.
Autor ovog rada je David Čanić, a link na njegov cijeli diplomski rad možete pronaći na kraju članka.
Anatomija i fiziologija hrskavice
Zglobna hrskavica je posebno tkivo u ljudskom tijelu koje za razliku od drugih organa, kao što su jetra ili koža, nema opskrbu krvlju, inervaciju i limfnu opskrbu. Stoga se opskrba hrskavice hranjivim tvarima, kisikom i uklanjanje štetnih tvari odvija difuzijom, prema, i od sinovijalne tekućine i subhondralne kosti (7). Postoje 3 osnovna tipa hrskavice: hijalina, fibrozna i elastična. Hijalina hrskavica je najčešća i nalazimo je u strukturama kao što su nos, traheja te na krajevima dugih kostiju. Njezine uloge u zglobovima su smanjenje trenja između dvije artikularne plohe zgloba te funkcija poput biomehaničke opruge. Fibrozna hrskavica je intermedijarni oblik između gustog vezivnog tkiva i hijaline hrskavice koja se nalazi u područjima koja su pod opterećenjem većih sila. Nalazimo ju u intervertebralnim diskovima i pubičnoj simfizi. Elastična hrskavica se nalazi u strukturama koje zahtijevaju fleksibilnost poput nosa i epiglotisa.
Ozljede hrskavica
Klasifikacija
Ozljede hrskavice su česta su patologija vezana uz sport i degenerativne bolesti poput osteoartritisa (OA). Ove ozljede mogu imati velik utjecaj na funkciju zglobova, razinu boli i kvalitetu života. Kao rezultat toga, esencijalno je imati jasan i dosljedni sistem za klasifikaciju ozljeda hrskavice i procjenu njihove ozbiljnosti. Postoji nekoliko različitih klasifikacija korištenih za oštećenja hrskavice, a svaka od njih ima svoje prednosti i mane. Jedna od najčešće korištenih je International Cartilage Regeneration and Joint Preservation Society (ICRS). Ova klasifikacija uzima u obzir dubinu i površinu lezije. Temelji se na vizualnom prikazu površine hrskavice i subhondralne kosti te stupnju omekšanja i fragmentacije hrskavičnog tkiva. Sastoji se od 5 stupnjeva u rasponu od 0 do 4. U stupnju 0 hrskavica je normalnog izgleda, glatke površine i bez vidljivih defekata. Stupanj 1a znači da nema vidljivih lezija ali je prisutno omekšanje. Stupanj 1b označava površinsko oštećenje hrskavice s manjim pukotinama na površini koje se ne protežu u dublje slojeve, a u hrskavici s oštećenjem stupnja 2 dolazi do gubitka djelomične debljine hrskavice s defektima koji se protežu u dublje slojeve (<50% dubine tkiva), ali ne dosežu subhondralnu kost. Stupanj oštećenja 3 dijelimo u 4 pod stupnja. Stupanj 3a: defekti koji zahvaćaju >50% debljine hrskavice. Stupanj 3b: defekti koji se protežu do kalcificiranog sloja hrskavice. Stupanj 3c: defekti koji prolaze kroz kalcificirani sloj do subhondralne kosti, ali ne prolaze kroz nju. Stupanj 3d: pukotine >50% debljine s pojavom mjehurića na površini. Najopsežniji stupanj ozljede hrskavice, stupanj 4, karakteriziran je izrazitim abnormalnim oštećenjem s penetracijom kroz subhondralnu kost. ICRS klasifikacija je korisna jer pruža jednostavan i standardiziran način opisivanja ozbiljnosti hrskavične lezije (14). Ipak, ICRS ima svoja ograničenja. Poput ostalih klasifikacija, subjektivna je i pod utjecajem je znanja i vještina onoga koji procjenjuje štetu. Također, ne uzima u obzir lokalizaciju i veličinu oštećenja što može utjecati na konačnu odluku o modalitetu liječenja. Stoga bi ova klasifikacija trebala biti združena s ostalim metodama procjene lezija hrskavice.
Etiologija i patofiziologija
Hrskavične lezije kategoriziramo u dvije skupine, degenerativne i fokalne lezije.
Degenerativne lezije su označavaju lezije sa slabo definiranim rubovima različitih dubina. One su najčešće posljedica osteoartritisa, degenerativnog trošenja hrskavice i podliježeće subhondralne kosti. Gubitak hrskavice u zglobu rezultira povećanjem sila trenja u zglobu te smanjenjem sposobnosti zgloba da služi kao biomehanička opruga. Tako umanjena sposobnost zahvaćenog zgloba da reducira trenje i djeluje kao opruga, rezultira povećanom osjetljivošću na daljnja oštećenja i bržom degradacijom (17). Loeser i suradnici (18) zagovaraju činjenicu da će abnormalne mehaničke sile na hrskavicu uzrokovati protuupalni odgovor hondrocita, rezultirajući otpuštanjem upalnih medijatora među kojima se ističu leukotrieni, prostaglandini, citokini i kemokini. Svi navedeni upalni medijatori stimuliraju kataboličku aktivnost unutar hrskavičnog tkiva što dovodi do daljnjih oštećenja hrskavice. Osteoartritis je najčešći uzrok hrskavičnih lezija kod pacijenata starijih od 40 godina (19). Prema etiologiji, dijeli se u dvije podgrupe: primarni koji se javlja idiopatski ili netraumatski, i sekundarni koji se javlja kao posljedica traume ili kroničnog mehaničkog oštećenja. Čimbenici rizika koji povećavaju rizik od OA su prekomjerna tjelesna težina koja povećava količinu stresa nanesenu hrskavičnom tkivu, gubitak potpornih struktura kao što je oštećenje ligamenata, starija dob, pozitivna obiteljska anamneza, prijašnje ozljede ili operacije (20).

Druga grupa hrskavičnih lezija su fokalne lezije, karakterizirane jasno označenim rubovima različitih dubina. Sportovi, padovi ili automobilske nesreće najčešći su uzrok nastanka fokalnih lezija u pacijenata mlađih od 40 godina. Primarni uzrok fokalnih lezija je direktan udarac na površinu zgloba što rezultira oštećenjem hrskavice i subhondralne kosti (19). Mehanizam ozljede može varirati ovisno o aktivnosti ili nesreći, a najčešće uključuje iznenadan jak udarac ili rotirajuću kretnju u zahvaćenom zglobu. Početna ozljeda površine zgloba uzrokuje oštećenje zglobne hrskavice i subhondralne kosti. To uključuje otpuštanje gore navedenih proupalnih citokina i faktora rasta poput TGF-β (eng. tumor growth factor β), koji zajedno s faktorom rasta nalik inzulinu (eng. insulinlike growth factor 1, IGF-1) stimulira proliferaciju hondrocita te potiče sintezu ECM-a. kao odgovor na navedenu ozljedu, iz trombocita se otpušta faktor rasta koji potiče iz trombocita (eng. platelet-derived growth factor, PDGF), koji stimulira migraciju i proliferaciju mezenhimalnih matičnih stanica koje će se diferencirati u hondrocite. Tijekom vremena, hondrociti ozlijeđene hrskavice sintetiziraju nove komponente matriksa s ciljem popravka oštećenja. Međutim novonastalo hrskavično tkivo koje se formira često je manje izdržljivo i funkcionalno nego originalna hrskavica iz više razloga. Novonastalo tkivo je fibrozno ili fibrokartilaginozno, što znači da sadržava više kolagenih vlakana a manje proteoglikana nego hijalina hrskavica. Još jedna mana cijeljenja hrskavice je smanjena mogućnost regeneracije. Hrskavica je avaskularna struktura, što znači da kroz nju ne prolaze krvne žile, zbog čega za vrijeme cijeljenja ima ograničenu opskrbu kisikom i hranjivim tvarima što uvelike smanjuje opseg regeneracije.
Klinička slika
Simptomi uslijed oštećenja hrskavice mogu se razlikovati ovisno o osnovnom stanju. U bolesnika s OA, defekti hrskavice mogu uzrokovati bolove u zglobovima, ukočenost i oticanje. Kako bolest napreduje, pacijenti mogu doživjeti nestabilnost zglobova, smanjen raspon pokreta i poteškoće u obavljanju svakodnevnih aktivnosti poput hodanja ili penjanja stepenicama. U nekim slučajevima pacijenti mogu razviti koštane izbočine, što može uzrokovati dodatnu bol i nelagodu (20). U bolesnika s OCD-om*, simptomatologija u početku nalikuje onoj u pacijenata s OA. Defekti hrskavice dovode do bolova u zglobovima, oticanja i ukočenosti. Pacijenti mogu osjetiti blokadu u zglobu pri izvođenju pokreta, što može ograničiti pokretljivost i ometati dnevne aktivnosti. U težim slučajevima, fragmenti hrskavice ili kosti mogu se odlomiti i plutati unutar zglobnog prostora, uzrokujući daljnja oštećenja i upalu (26). U slučajevima traumatske ozljede hrskavice, pacijenti osjećaju bol i oteklinu u zahvaćenom zglobu. Javljaju se i poteškoće s oslanjanjem na taj zglob ili obavljanjem aktivnosti koje zahtijevaju pokretljivost zahvaćenog zgloba. U nekim slučajevima, pacijenti mogu osjetiti ili čuti pucketanje ili škljocanje prilikom pomicanja zgloba. Važno je napomenuti da neki pacijenti s defektima hrskavice u početku neće osjetiti nikakve simptome, osobito u slučajevima blagog ili ranog stadija oštećenja. Međutim, kako se stanje pogoršava, simptomi postupno razvijaju tijekom vremena. Stoga je važno da bolesnici s poznatim čimbenicima rizika za defekte hrskavice, poput sportaša ili osoba s poviješću ozljeda zglobova, budu redovito nadzirani i kontrolirani od strane pružatelja zdravstvenih usluga (30).
*Osteochondritis dissecans (OCD) je stanje uzrokovano ponavljanim mikrotraumama i ishemijama koje dovode do osteonekroze subhondralne, čineći hrskavicu podložnom oštećenjima (7,13,25).
Mikrofrakture
Indikacije i kontraindikacije
Opće indikacije za tehniku mikrofraktura uključuju defekte pune debljine hrskavice, nestabilnu hrskavicu koja prekriva subhondralnu kost i leziju djelomične debljine koju, kada se sondira, hrskavica jednostavno ostruže do kosti. Kada se govori o koljenu, geometrijska mjerenja pomažu u određivanju indikacija za mikrofrakture. Povlačeći linije koje idu od kuka do gležnja procjenjuju se mjesta najvećeg opterećenja na koljenu. Ako linija prolazi unutar 25% od neutralne linije (prolazi kroz sredinu tibije) medijalno ili lateralno, tada je koljeno poželjno za tehniku mikrofrakture. Zglob na kojem je izveden prethodni kirurški zahvat ili se nalazi u nepravilnom položaju može stvoriti neugodno okruženje kojem će odgovarati ovakav artroskopski zahvat. Ako je nepravilni položaj povezan s degenerativnim promjenama, osteotomija i artroskopski zahvat su potrebni (50). Dob pacijenta nije kontraindikacija ali pokazalo se da akutne lezije kod pacijenata koji su mlađi od 35 godina imaju bolji ishod i brži oporavak od starijih pacijenata. Isto tako veličina lezije ne smatra se kontraindikacijom. Dokazano je da velike akutne lezije reagiraju na postupak mikrofrakture, iako se pokazalo da lezije manje od 400 nm2 imaju bolji odgovor na mikrofrakture od većih (46). Indikaciju predstavljaju i pacijenti koji imaju umjerene simptome i lezije srednje veličine koje odgovaraju stupnju 3 i 4 po Outerbridge klasifikaciji. Točnije, mikrofrakture se preporučaju kod pacijenata koji su aktivni s malim lezijama (<2 - 3 cm2) i simptomima koji nisu veći od umjerenog te bolesnici manjeg zahtjeva s većim lezijama (>2 - 3 cm2) i blagim simptomima. Važnije od veličine lezije je visina hrskavičnog ruba koji okružuje leziju. Visina ruba je važna jer onemogućava da se ugrušak razlije van mjesta lezije15 već ga zadržava na mjestu. Ovakav problem se javi često kod degenerativnih lezija, u kojem slučaju nizak hrskavični rub predstavlja kontraindikaciju za zahvat. Posebnu kontraindikaciju za mikrofrakturu predstavljaju pacijenti koji ne žele ili nisu u mogućnosti držati se i pratiti strogi rehabilitacijski protokol te nemogućnost korištenja druge noge kao oslonac tokom postoperativnog razdoblja kada se ne smiju oslanjati na operirani zglob. Pri liječenju kroničnih degenerativnih lezija posebne kontraindikacije uključuju sistemske imunosno posredovane bolesti, bolešću uzrokovan artritis ili bolesti hrskavice. Relativne kontraindikacije uključuju starije pacijente, zbog potencijalnih poteškoća sa hodom na štakama i nemogućnosti praćenja rigorozne rehabilitacije. Ostale kontraindikacije uključuju globalnu degenerativnu osteoartrozu s kapsularnim kontrakcijama, sinovitis i fleksijske kontrakture. Također, mikrofrakture se ne bi smjele koristiti kod pacijenata koji imaju defekte dublje od 10 mm. Očekivanja svakog pacijenta također treba uzeti u obzir u procesu odabira pacijenata. Ta očekivanja uključuju vrijeme oporavka, ublažavanje simptoma i povratak aktivnostima (48).
Operacijska tehnika - koljeno
Kirurška tehnika mikrofraktura najširu primjenu ima upravo na koljenu. Tehnika je kompleksna, a pojednostavljena shema samog zahvata biti će opisana u nastavku. Zahvat započinje detaljnim artroskopskim pregledom koljena kroz tri otvora kroz koja prolaze ulazna kanila, artroskop i radni instrumenti. Prvo se napravi pregled suprapatelarne vrećice, medijalnog i lateralnog žlijeba, patelofemoralnog zgloba, interkondilarnog usjeka i njegovog sadržaja, te medijalnog i lateralnog odjeljka, uključujući stražnje rogove oba meniska. Posebnu pozornost treba obratiti na ožiljke prednjeg intervala, plike i lateralni retinakul koji mogu uzrokovati probleme povećavši kompresiju između površina hrskavica. Nakon što se artroskopski utvrdi lezija pune debljine hrskavice, slijedi proces otkalnjanja nestabilne hrskavice. Ručna zakrivljena kireta i resektor punog radijusa mogu se koristiti za uklanjanje labave ili rubno pričvršćene hrskavice natrag na njezin stabilni rub nakon čega se odstrani kalcificirana hrskavica. Potrebno je održati cjelovitost subhondralne ploče. Važno je da se defekt debridira dovoljno duboko da se ukloni kalcificirani sloj hrskavice, ali ne toliko duboko da se ošteti subhondralna ploča. Ovako pripremljena lezija s pravilnim rubovima omogućava zadržavanje ugruška koštane srži na mjestu dok traje formiranje ugruška. Artroskopska šila koriste se u obradi goljenične i bedrene kosti za izradu višestrukih rupa ili "mikrofraktura".
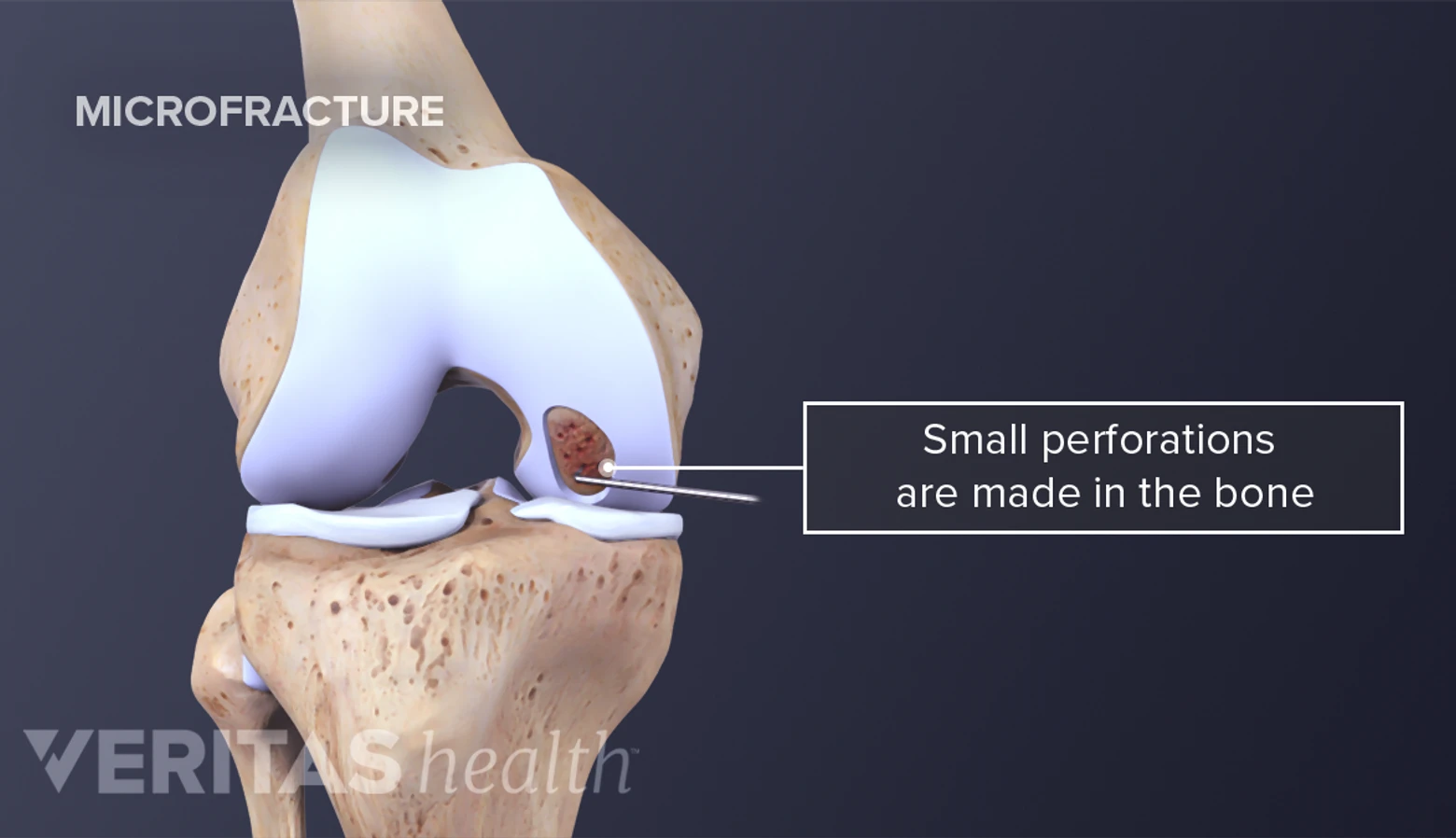
Šilo se najčešće koriti pod kutovima 30° ili 45°. Šilo od 90° koristi se za patelu ili druge meke kosti, ali ga u tom slučaju treba pomicati samo ručno, a ne čekićem. Počevši od periferije prema sredini rade se mikrorfakturne rupe koje su dovoljno udaljene međusobno da se ne bi probijale jedna u drugu, a subhondralna ploča između njih ostala zaštićena. Kada se dosegne određena dubina (2 do 4 cm) vide se kapljice masti. Po završetku stvaranja mikrofraktura, tlak pumpe tekućine za irigaciju se smanjuje kako bi se promatralo otpuštanje kapljica masnoće koštane srži i krvi iz rupa mikrofraktura. Za vrijeme mikrofrakture formira se hrapava površina koja se ne smije čistiti ni ukloniti jer ona omogućava ugrušku srži da bolje adherira na tu lokaciju. Rijetko se koriste intraartikularni drenovi jer je cilj zahvata formirati i stabilizirati ugrušak koštane srži dok pokriva leziju. Hrskavica patele kompleksniji je problem. Prvi korak je ukloniti nestabilnu hrskavicu i kalcificirani sloj hrskavice brijačem i kutnom ili ravnom kiretom. Preporuča se pristup subhondralnoj kosti sa šilom od 90°. Ako je kost prečvrsta za ulazak, pravi se drugi otvor točno iznad lateralnog meniska, pod izravnom artroskopskom vizualizacijom, s koljenom u fleksiji od 40° do 60°. Šilo pod kutom od 45° se pomakne na preparirani defekt, uđe se u defekt i naprave mikrofraktrne rupe (50). Kod kroničnih lezija radi se isti postupak iako je samo izvođenje zahtjevnije zbog degenerativnih promjena, eburnizacije kosti i koštane skleroze sa zadebljanjem subhondralne ploče. Važno je da rub stvoren oko defekta bude dovoljno debeo da zadrži ugrušak koštane srži. Pacijenti s tankom hrskavicom kakva se viđa kod uznapredovanih degenerativnih lezija, nisu dobri kandidati za tehniku mikrofrakture. Kod kroničnih lezija još treba uzeti u obzir ukočenost, priraslice, smanjeni volumen zgloba i sinovitis. Prednji interval je kirurški važan prostor između infrapatelarnog masnog jastučića i tetive patele sprijeda i prednje tibije i poprečnog meniskalnog ligamenta straga (51). Na prednjem intervalu koljena oštećenog degenerativnim promjenama često se mogu pronaći ožiljci kao posljedica prijašnjih operacija. Kako bi se postigla pravilna kinematika koljena, prednji interval je potrebno otvoriti. Po otvaranju može se naići na ožiljkavanja prednjeg infrapatelarnog masnog jastučića. Ako postoje ožiljci u prednjem intervalu, ne može doći do odvajanja tetiva patele i tibije kada se koljeno miče u rasponu od 0 do 120 stupnjeva, što uzrokuje bolnu kompresiju zgloba. Ova kompresija sama po sebi može oštetiti hrskavicu. Prednji interval se otvara otpuštanjem područja koji se nalazi neposredno ispred intermeniskalnog ligamenta. Ovaj se manevar izvodi od medijalno prema lateralno, neposredno ispred perifernog ruba prednjeg roga svakog meniskusa. Smanjeni volumen zgloba rješava se širenjem zglobne čahure s fiziološkom otopinom koja se ubrizgava u zglob. Sve intraartikularne adhezije se uklone elektrokauterizacijom. Suprapatelarna plika se uklanja kako bi se obnovio volumen suprapatelarnog zgloba. Nakon toga se postiže hemostaza mekih tkiva, a uklanjaju se ostefiti koji ograničavaju ekstenziju. Sinovitis se ablacira aparatom za elektrokautersku ablaciju od 70°, pazeći da se ne ekscizira kapsula (50).
Rehabilitacija
Krucijalno je naglasiti važnost fizikalne terapije nakon zahvata. Većina studija koja su pokazala loše rezultate mikrofraktura može biti posljedica u različitog rehabilitacijskog protokola, tvrde Steadman i suradnici. Postoperativni program je dizajniran da pruži najbolje okolišne uvjete novim pluripotentnim stanicama iz koštane srži kako bi se mogle diferencirati u novu funkcionalnu hrskavicu. Spomenuta diferencijacija i sazrijevanj moraju se odvijati polagano ali konzistentno. Željeno poboljšanje nakon zahvata očekuje se unutar 12 mjeseci postoperativno. Tokom tog poduljeg perioda novo tkivo sazrijeva, bol i oteklina se povlače, a pacijentima se vraća samopouzdanje i udobnost tijekom povećanih razina aktivnosti. Program postoperativne rehabilitacije nakon mikrofrakture zahtijeva razmatranje nekoliko čimbenika. Specifični preporučeni protokol ovisi o anatomskom mjestu i veličini defekta. Navedeni su čimbenici ključni za određivanje idealnog postoperativnog programa. Na primjer, ako se drugi intraartikularni zahvati (rekonstrukcija prednjeg križnog ligamenta i drugi) izvode istodobno s mikrofrakturom, programi rehabilitacije prilagođavaju se prema potrebi (50).
Program za rehabilitaciju i povratak normalnim dnevnim aktivnostima koje je objavio Texas Metroplex institut podijeljen je u 4 faze. Prva faza je rana protektivna faza i traje prvih 6 tjedana, a ciljevi su: štititi tkivo koje zacjeljuje od opterećenja i sila smicanja, postići opseg kretanja (ROM) 0° do 120°, kontrolirati postoperativnu bol i oteklinu, postići fziološku snagu proksimalnih mišića i neovisnost s programom vježbanja kod kuće. Plan tretmana je korištenje kontinuiranih pasivnih kretnji (eng. Continuous Passive Motion, CPM) 6 sati dnevno prvih 6 tjedana, aktivni potpomognuti raspon pokreta (engl. Active Assisted Range of Motion, AAROM) bez boli, ekstenzije s ručnikom, postizanje patelarne mobilizacije, raditi vježbe s ispruženom nogom (eng. Straight Leg Raise, SLR), korištenje stacionarnog bicikla kada ROM dopušta (3. do 4. tjedan) i kardiovaskularne vježbe gornjeg ekstremiteta. Da bi se moglo prijeći na 2. fazu potrebno je postići ROM 0° do 120°, snagu proksimalnih mšića 5/5 i mogućnost izvođenja SLR testa bez zastoja. U drugoj fazi (6. do 12. tjedan) cilj je postići: ROM 0° do normalnih granica, normalnu patelarnu mobilnost, popeti se uz stube s dobrom kontrolom i bez boli, ali izbjegavati silaženje niz stepenice dok se ne postigne puna kontrola kvadricepsa. Plan tretmana sastoji se od progresivnog prenošenja težine na ozlijeđeno koljeno sa štakama, micanje proteze kada se postigne SLR 20 ponavljanja bez zastoja, vježbi u bazenu, potiska nogama 0 do 60°, mini čučnja, vježbi propriocepcije, SLR s progresivnim otporom i kućnih vježbi. Kako bi se moglo prijeći na 3. fazu potrebno je biti sposoban izvesti ROM 0° do normalnih granica, normalan obrazac hoda, hod uz stube od 20 cm i normalnu patelarnu mobilnost. U 3. fazi (12. do 18. tjedan) cilj je vratiti se normalnim dnevnim aktivnostima, poboljšati fleksibilnost donjih ekstremiteta, popeti se uz stepenice s dobrom kontrolom i bez boli i postizanje 85% simetrije udova na izokinetičkom testiranju pri čemu treba izbjegavati bol ako se javi kod terapeutskih vježbi i funkcionalnih aktivnosti. Treba izbjegavati trčanje do odgovarajućeg razvoja snage i odobrenja kirurga. Od vježbi rade se progresivni čučnjevi, potisak nogama s naglaskom na ekscentrični dio pokreta, napredne vježbe propriocepcije, retrogradna pokretna traka za trčanje, pregibi stražnje lože, izokinetičke vježbe nakon 4 mjeseca i istezanje drugih ekstremiteta. Kriteriji za 4. fazu jednaki su ciljevima postignutim u trećoj fazi. Ova faza rezervirana je prvenstveno za sportaše i mlađe pacijente. U 4. fazi (nakon 18. tjedna) nastoji se vratiti pacijenta sportskim aktivnostima s ciljem postizanja maksimalne snage i fleksibilnosti koje zahtijeva određeni sport i postizanje >85% simetričnosti udova na testu skoka. Program uključuje nastavak jačanja snage donjih ekstremiteta, fleksibilnosti i agilnosti, trčanje, spremnost za sportske aktivnosti, praćenje pacijentove aktivnosti i ohrabrivanje za izvođenje vježba kod kuće. Kriteriji za otpuštanje pacijenta su uspješnost izvođenja testa skoka sa >85% simetričnosti udova, fleksibilnost prikladna sportu kojim se pacijent bavi i neovisnost s programom u teretani za održavanje i napredovanje terapijskih vježbi (52).
Izvor slike: https://anika.com/medical/products/nanofx/
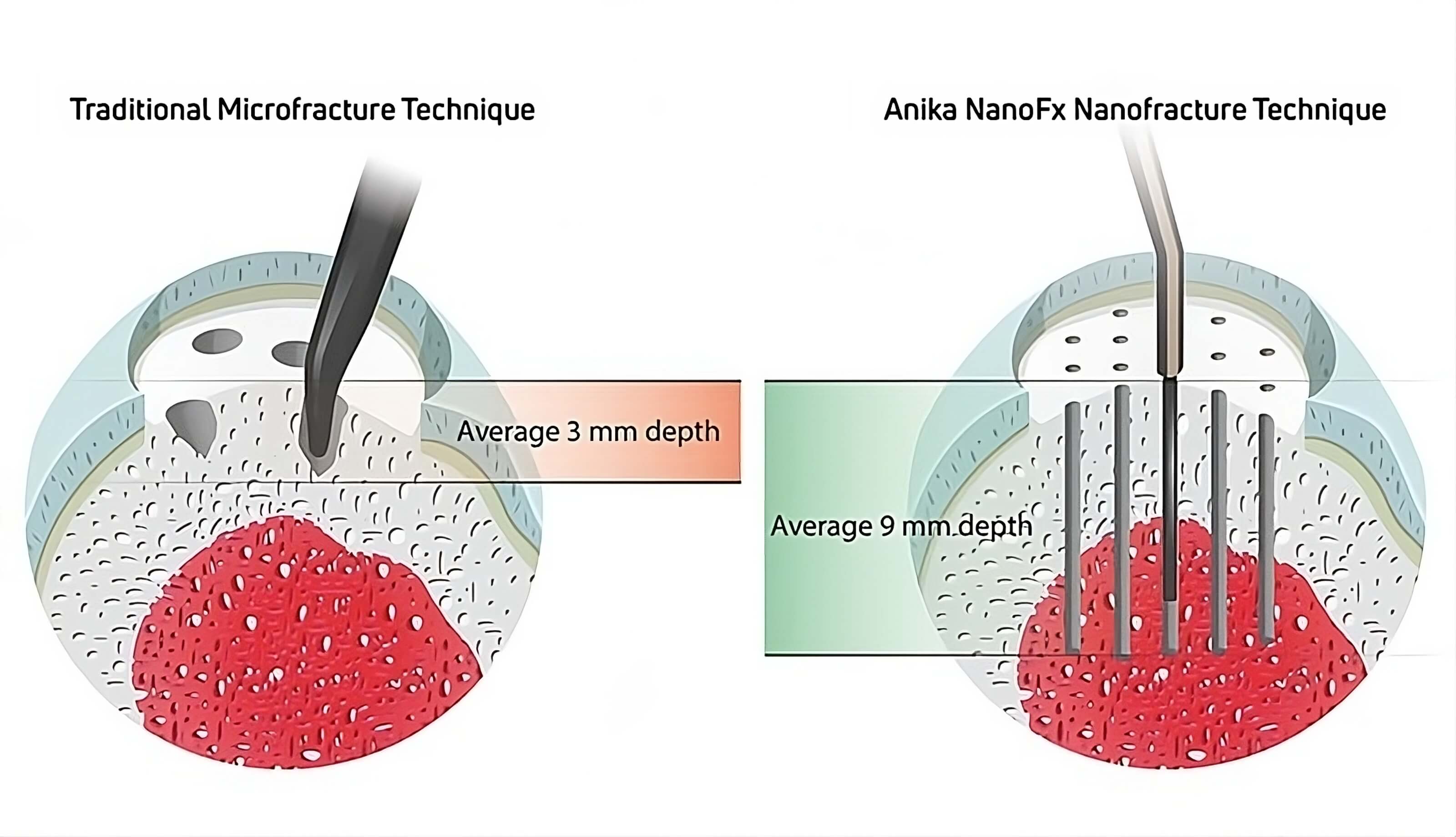
Nanofrakture
Ponovni osvrt na učinke subhondralne kosti u obnavljanju hrskavice otvorio je nove puteve za potencijalna poboljšanja, posebice kada se razmatra formacija i dubina kanala, regrutiranje stanica i posljedična količina i kvaliteta novostvorene hrskavice (69,70). Postupak nanofraktura nova je metoda subhondralnog bušenja koji je odobrila Američka agencija za hranu i lijekove, s uređajem i tehnikom nalik na tehniku mikrofrakture, pri čemu je promjer igle tanji a dubina perforacije subhondralne kosti dublja. Ova tehnika bazira se na najnovijim saznanjima u stimulaciji mezenhimalni matičnih stanica. Tehnika nanofraktura uključuje kanuliranu vodilicu s vrhom pod kutom od 15° kako bi se olakšao pristup mjestu oštećenja. Subhondralne perforacije kosti izvode se iglom debljine jedan milimetar koja se provlači kroz kanuliranu vodilicu. Igla koja je podvrgnuta testiranju da ne pukne doseže dubinu prodiranja na definiranoj duljini od devet milimetara. To je utvrđeno nakon što su studije na leševima pokazale da bi duža igla imala veći rizik od loma igle a da nužno ne bi imala nikakvu prednost Indikacije i preoperativna obrada jednaki su onim u postupku mikrofraktura. Po završetku preparacije defekta, subhondralno bušenje se izvodi na sustavan, spiralni način počevši od periferije lezije. Igla od jednog milimetra umetnuta je u lumen vodilice. Vrh vodilice se postavlja na pripremljeno ležište defekta i lagani udarci čekića na proksimalnom kraju igle pomiču vrh u subhondralnu kost na dosljednoj, stop-kontroliranoj dubini od devet milimetara bez toplinskog oštećenja tkiva. Igla se uklanja i uzastopni subhondralni koštani kanali postavljaju se kroz ležište defekta prema definiranom uzorku. Svaka perforacija postavljena je na udaljenosti od oko tri milimetra kako bi se dobila ravnomjerna raspodjela. Potrebno je održavati odgovarajuće koštane mostove između svakog kanala kako bi se zaštitila mehanička stabilnost subhondralne kosti tijekom postoperativnog remodeliranja. Ispiranje zgloba završava postupak uklanjanja labavih koštanih čestica i ostataka hrskavice. Intraartikularni drenovi se ne koriste kako bi se izbjegle smetnje u stvaranju ugruška koštane srži, regrutiranju stanica i diferencijaciji (71). Zedde i suradnici su napravili studiju u kojoj su htjeli pokazati razliku uspješnosti nanofrakture i mikrofrakture. Na 4 odrasle ovce napravili su medijalnu parapatelarnu artrotomiju na način da su razotkrili medijalne femoralne kondile u obje stražnje noge. Na jednoj nozi su napravili mikrofrakturu a na drugoj nanofrakturu prema prije opisanim postupcima. Postoperativno su životinje smjestili u štalu s ograničenom mogućnošću kretanja i naslanjanja. Nakon operacije su puštene da se slobodno kreću bez ograničenja. 6 mjeseci nakon operacije uzeti su se 2 x 2cm uzorci operiranih kondila. Mikro-CT uzorak mikrofrakture pokazao je ograničenu dubinu perforacije šila. Kanali u obliku stošca imali su velike promjere na spojnoj površini; stijenke kanala pokazivale su visok stupanj pravilnosti sa značajnim zbijanjem trabekularne kosti, što je dovelo do učinka brtvljenja i stoga ograničene komunikacije kanala s okolnim trabekularnim kanalima, te razvoja novoformiranih trabekula unutar kanala. U tri od četiri uzorka mikrofrakture pronađene su subhondralne ciste promjera od 7 mm do 12 mm u blizini perforacije. Mikro-CT kondila tretiranih nanofrakturom pokazao je veću dubinu perforacija, s manjim promjerom u usporedbi s onima s mikrofrakturama, s prirodnim nepravilnostima stijenki kanala, odsutnošću trabekularnog zbijanja oko perforacija i izvanrednom komunikacijom između pre -postojećih kanala i perforacija, te neotrabekularnu remodelaciju unutar kanala. Nijedan od uzoraka nanofrakture nije pokazao stvaranje subhondralne ciste. Ključno otkriće ove studije je da je perforacija iglom malog promjera u kondilarne defekte pune debljine pokazala manje zbijanje subhondralne kosti i bolje očuvanje trabekularnih struktura u usporedbi s tretmanom mikrofraktura. Sekundarni nalaz je da je pregradnja kosti nakon nanofrakture rezultirala trabekularnom strukturom nevjerojatno sličnom onoj nativne subhondralne kosti (72).
Implantati u koje urasta hrskavica „Scaffolds“
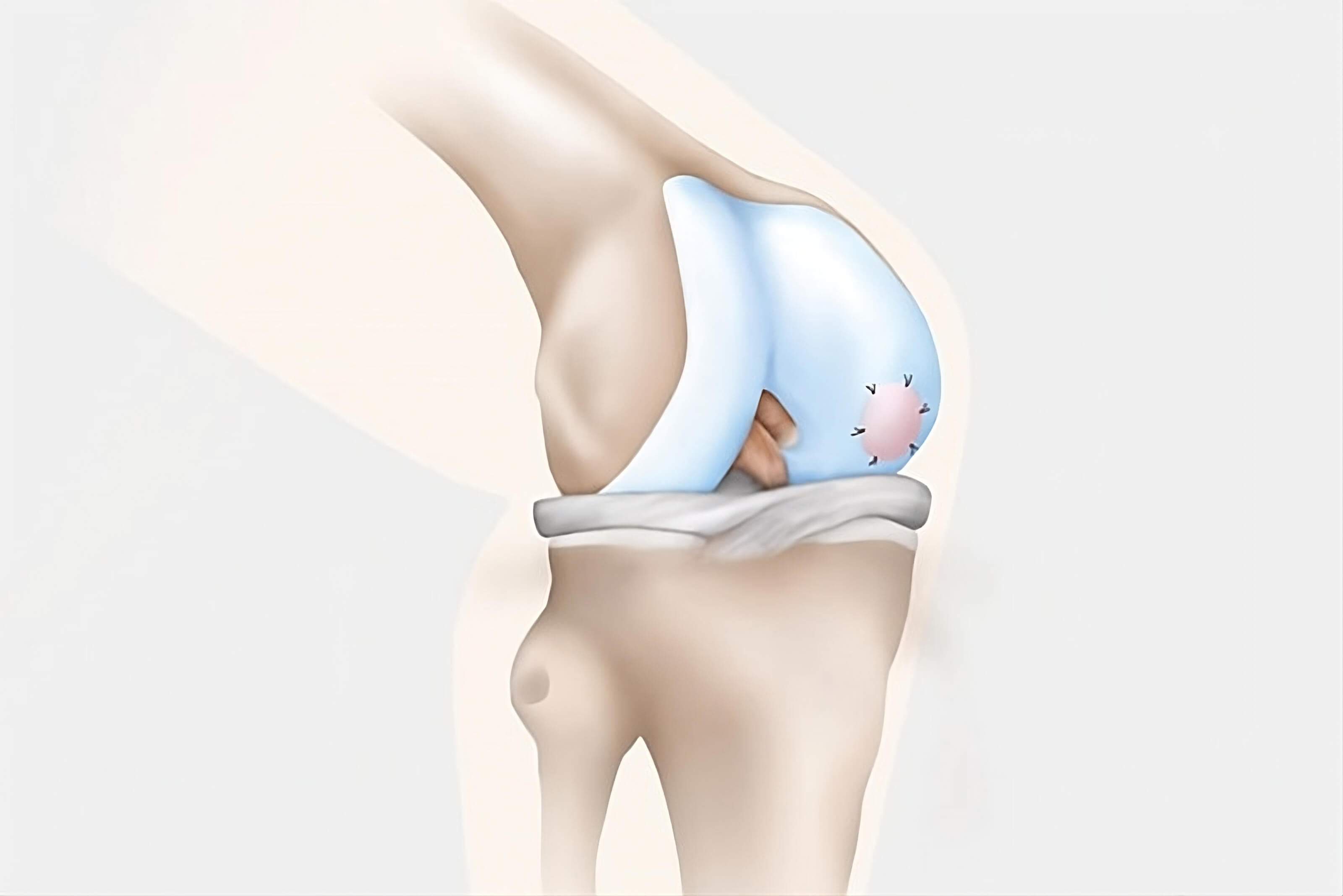
„Scaffolds“, tj. implantati u koje urasta okolna zdrava hrskavica koriste se za liječenje dubokih i opsežnih defekata hrskavice. Njihova prednost je u tome što se mogu koristiti i nakon prethodno neuspjelog zahvata na zglobnoj hrskavici (73). Kako je do sada napomenuto, postupak mikrofraktura, pa tako i ostali kirurški zahvati na zglobovima, ne dovode do 100%-tnog povrata funkcije i čvrstoće hrskavice. „Scaffold“-i su privremeni 3D biorazgradivi implantati koji se postavljaju unutar oštećene hrskavice s ciljem potpomaganja oporavka i regeneracije. Postoje četiri skupine implantata: umjetni polimerni, bazirani na proteinima, bazirani na ugljikohidratima te kombinacija navedenih materijala. Tipično ih nalazimo u jednom od tri oblika: membrane, hidrogelovi ili mrežice (74). Karakteristike kojim se odlikuju su prvenstveno njihova mogućnost biokompatibilnosti, što sprječava nastanak imunosne reakcije na strano tijelo. Osim toga, nema opasnosti od toksične reakcije prilikom njihove razgradnje u tijelu. Glavna funkcija im je omogućiti „mrežu“ optimalnih uvjeta za rast nove hrskavice, a istovremeno održavati dovoljnu poroznost kako bi strukture potrebne za regeneraciju hrskavice mogle pristizati u oštećeno tkivo. Posebna pažnja prilikom odabira i proizvodnje odgovarajućeg „scaffold“-a je pobrinuti se da odabrani materijal izdrži fiziološke napore kojima je zglob izložen, a da pritom ne djeluju negativno na funkciju zloba (75). Moguće je implantat koristiti kao dio matriks asistirane autologne transplantacije hondrocita ( eng. matrix-assisted autologous chondrocyte transplantation, MACT) ili pak kao samostalni postupak nakon mikrofraktura, u kojem implantat umećemo nakon obrade hrskavice i subhondralne kosti na mjesto oštećenja (75,76).
Izvor: https://www.aesculapbiologics.com/en/patients/novocart-3d.html
Benefiti „scaffold“-a u zadnjih 15 godina, od kada su u upotrebi, su brojni. Kirurški postupak njihovog umetanja zahtjeva samo jedan zahvat, nema nepotrebnog odstranjivanja zdrave hrskavice i kako je već spomenuto, može se raditi nakon prethodno neuspjele druge metode. Kao najvažniju negativnu stranu ove metode važno je napomenuti kako još nema dovoljno studija koje prikazuju dugoročne rezultate, pošto je metoda relativno nova, ali kratkoročni ishodi su za sada obećavajući (75).
Zaključak
Zaključno, ovaj pregledni rad daje opsežan pregled tehnike mikrofrakture kao kirurškog pristupa liječenju zglobnih lezija. Rasprava je obuhvatila ključne aspekte kao što su histologija hrskavice, klasifikacija zglobnih lezija, indikacije i kontraindikacije za mikrofrakturu, kirurška tehnika i kombinacija mikrofrakture sa „scaffold“-ima. Osim toga, pregled se dotakao novog koncepta nanofrakture i uloge „scaffold“-a u poboljšanju oporavka tkiva, koje su napravile korak naprijed u usavršavanju ovog zahvata. Histološko razumijevanje hrskavice temeljno je za razumijevanje razloga iza tehnike mikrofrakture. Klasificiranje zglobnih lezija pomaže u identificiranju odgovarajućih slučajeva u kojima mikrofraktura može biti korisna, a sama tehnika, koja uključuje stvaranje malih perforacija u subhondralnoj kosti, pokreće reakciju cijeljenja stvaranjem fibrokartilaginoznog tkiva. Ovaj proces ima za cilj ublažiti simptome i poboljšati funkciju zgloba kod pacijenata sa žarišnim defektima hrskavice. Kombinacija mikrofrakture sa „scaffold“-ima predstavlja obećavajući put za popravak hrskavice pružajući potpornu strukturu za staničnu infiltraciju, taloženje matriksa i naknadnu regeneraciju tkiva. Važno je napomenuti da postoje alternativne mogućnosti liječenja artikularnih lezija, kao što je ACI i transplantacija osteohondralnog autotransplantata (OAT). Ove su tehnike pokazale uspješne rezultate u određenim slučajevima, ali također dolaze s ograničenjima kao što su morbiditet donorskih mjesta, ograničena dostupnost i povećana složenost. Mikrofraktura, sa svojim relativno jednostavnim i isplativim pristupom, ostaje održiva opcija liječenja za širu populaciju pacijenata. Odluka o korištenju mikrofrakture trebala bi se temeljiti na pažljivom odabiru pacijenata, karakteristikama lezije i stručnosti kirurga. Prilikom odabira najprikladnijeg pristupa liječenju treba uzeti u obzir čimbenike kao što su veličina lezije, mjesto i dob bolesnika. Zaključno, tehnika mikrofrakture, sa svojim utvrđenim iskustvom, ostaje vrijedna opcija liječenja artikularnih lezija. Jednostavnost, isplativost i potencijal za regeneraciju tkiva čine ovu metodu održivim izborom za širok raspon pacijenata. Kombinacija mikrofrakture sa „scaffold“-ima i koncept nanofrakture u nastajanju, pružaju uzbudljive izglede za poboljšanje rezultata u popravku hrskavice.
1. Steinwachs MR, Engebretsen L, Brophy RH. Scientific Evidence Base for Cartilage Injury and Repair in the Athlete. CARTILAGE. 2012 Jan;3(1_suppl):11S-17S.
2. New York Orthopaedic Surgeon Performs Innovative Microfracture Procedure On Arthritic Knees Avoiding Knee Replacement Surgery [Internet]. PRWeb. [cited 2023 Jun 7]. Available from:https://www.prweb.com/releases/2006/02/prweb350730.htm
3. Alford JW, Cole BJ. Cartilage Restoration, Part 1: Basic Science, Historical Perspective, Patient Evaluation, and Treatment Options. Am J Sports Med. 2005 Feb;33(2):295–306.
4. Alford JW, Cole BJ. Cartilage Restoration, Part 2: Techniques, Outcomes, and Future Directions. Am J Sports Med. 2005 Mar;33(3):443–60.
5. Steadman JR, Rodkey WG, Rodrigo JJ. Microfracture: Surgical Technique and Rehabilitation to Treat Chondral Defects: Clin Orthop. 2001 Oct;391:S362–9.
6. Berta Á. Clinical experiences with cartilage repair techniques: outcomes, indications, contraindications and rehabilitation. Jt Dis Relat Surg. 2015 Aug 1;26(2):84–96.
7. Sophia Fox AJ, Bedi A, Rodeo SA. The Basic Science of Articular Cartilage: Structure, Composition, and Function. Sports Health Multidiscip Approach. 2009 Nov;1(6):461–8.
8. Janqeira L, Carneiro J. Hrskavica. In: Osnovi histologije. 11th ed. Beograd: Data Status; 2005. p. 128–33.
9. Seo SS, Kim CW, Jung DW. Management of Focal Chondral Lesion in the Knee Joint. Knee Surg Relat Res. 2011 Dec 30;23(4):185–96.
10. Yoon DM, Fisher JP. Chondrocyte Signaling and Artificial Matrices for Articular Cartilage Engineering. In: Fisher JP, editor. Tissue Engineering [Internet]. Boston, MA: Springer US; 2007 [cited 2023 Apr 30]. p. 67–86. (Advances in Experimental31 Medicine and Biology; vol. 585). Available from: http://link.springer.com/10.1007/978-0-387-34133-0_5
11. Mow VC, Ratcliffe A, Robin Poole A. Cartilage and diarthrodial joints as paradigms for hierarchical materials and structures. Biomaterials. 1992;13(2):67–97.
12. Mehana ESE, Khafaga AF, El-Blehi SS. The role of matrix metalloproteinases in osteoarthritis pathogenesis: An updated review. Life Sci. 2019 Oct;234:116786.
13. Sharifi AM, Moshiri A, Oryan A. Articular cartilage: injury, healing, and regeneration. Curr Orthop Pract. 2016 Nov;27(6):644–65.
14. Van Den Borne MPJ, Raijmakers NJH, Vanlauwe J, Victor J, De Jong SN, Bellemans J, et al. International Cartilage Repair Society (ICRS) and Oswestry macroscopic cartilage evaluation scores validated for use in Autologous Chondrocyte Implantation (ACI) and microfracture. Osteoarthritis Cartilage. 2007 Dec;15(12):1397–402.
15. Slattery C, Kweon CY. Classifications in Brief: Outerbridge Classification of Chondral Lesions. Clin Orthop. 2018 Oct;476(10):2101–4.
16. Hambly K. The use of the Tegner Activity Scale for articular cartilage repair of the knee: a systematic review. Knee Surg Sports Traumatol Arthrosc. 2011 Apr;19(4):604–14.
17. Willers C, Wood DJ, Zheng MH. A CURRENT REVIEW ON THE BIOLOGY AND TREATMENT OF ARTICULAR CARTILAGE DEFECTS (PART I & PART II). J Musculoskelet Res. 2003 Sep;07(03n04):157–81.
18. Loeser RF. Aging and osteoarthritis: the role of chondrocyte senescence and aging changes in the cartilage matrix. Osteoarthritis Cartilage. 2009 Aug;17(8):971–9.
19. Falah M, Nierenberg G, Soudry M, Hayden M, Volpin G. Treatment of articular cartilage lesions of the knee. Int Orthop. 2010 Jun;34(5):621–30.32
20. Chen D, Shen J, Zhao W, Wang T, Han L, Hamilton JL, et al. Osteoarthritis: toward a comprehensive understanding of pathological mechanism. Bone Res. 2017 Jan 17;5(1):16044.
21. Liu-Bryan R, Terkeltaub R. Emerging regulators of the inflammatory process in osteoarthritis. Nat Rev Rheumatol. 2015 Jan;11(1):35–44.
22. Lane Smith R, Trindade MC, Ikenoue T, Mohtai M, Das P, Carter DR, et al. Effects of shear stress on articular chondrocyte metabolism. Biorheology. 2000;37(1–2):95–107.
23. Mobasheri A, Batt M. An update on the pathophysiology of osteoarthritis. Ann Phys Rehabil Med. 2016 Dec;59(5–6):333–9.
24. Cross M, Smith E, Hoy D, Nolte S, Ackerman I, Fransen M, et al. The global burden of hip and knee osteoarthritis: estimates from the Global Burden of Disease 2010 study. Ann Rheum Dis. 2014 Jul;73(7):1323–30.
25. Gorbachova T, Melenevsky Y, Cohen M, Cerniglia BW. Osteochondral Lesions of the Knee: Differentiating the Most Common Entities at MRI. RadioGraphics. 2018 Sep;38(5):1478–95.
26. Bruns J, Werner M, Habermann C. Osteochondritis Dissecans: Etiology, Pathology, and Imaging with a Special Focus on the Knee Joint. CARTILAGE. 2018 Oct;9(4):346–62.
27. Boerckel JD, Mason DE, McDermott AM, Alsberg E. Microcomputed tomography: approaches and applications in bioengineering. Stem Cell Res Ther. 2014 Dec;5(6):144.
28. Gold GE, McCauley TR, Gray ML, Disler DG. Special Focus Session: What’s New in Cartilage? RadioGraphics. 2003 Sep;23(5):1227–42.
29. Levinsohn E, Baker B. Prearthrotomy diagnostic evaluation of the knee: review of 100 cases diagnosed by arthrography and arthroscopy. Am J Roentgenol. 1980 Jan 1;134(1):107–11.33
30. Aicale R, Tarantino D, Maffulli N. Overuse injuries in sport: a comprehensive overview. J Orthop Surg. 2018 Dec;13(1):309.
31. Lespasio MJ, Piuzzi NS, Husni ME, Muschler GF, Guarino A, Mont MA. Knee Osteoarthritis: A Primer. Perm J. 2017 Dec;21(4):16–183.
32. Christensen R, Bolvig J, Lund H, Bartels EM, Astrup AV, Hochberg MC, et al. Weight loss for overweight patients with knee or hip osteoarthritis. Cochrane Musculoskeletal Group, editor. Cochrane Database Syst Rev [Internet]. 2017 Nov 6 [cited 2023 May 24]; Available from: https://doi.wiley.com/10.1002/14651858.CD012526
33. Hsu H, Siwiec RM. Knee Osteoarthritis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 [cited 2023 May 24]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK507884/
34. Leite VF, Daud Amadera JE, Buehler AM. Viscosupplementation for Hip Osteoarthritis: A Systematic Review and Meta-Analysis of the Efficacy on Pain and Disability, and the Occurrence of Adverse Events. Arch Phys Med Rehabil. 2018 Mar;99(3):574-583.e1.
35. Vannabouathong C, Del Fabbro G, Sales B, Smith C, Li CS, Yardley D, et al. Intra-articular Injections in the Treatment of Symptoms from Ankle Arthritis: A Systematic Review. Foot Ankle Int. 2018 Oct;39(10):1141–50.
36. Yaftali NA, Weber K. Corticosteroids and Hyaluronic Acid Injections. Clin Sports Med. 2019 Jan;38(1):1–15.
37. Chao J, Wu C, Sun B, Hose MK, Quan A, Hughes TH, et al. Inflammatory Characteristics on Ultrasound Predict Poorer Longterm Response to Intraarticular Corticosteroid Injections in Knee Osteoarthritis. J Rheumatol. 2010 Mar;37(3):650–5.
38. Hall MP, Band PA, Meislin RJ, Jazrawi LM, Cardone DA. Platelet-rich Plasma: Current Concepts and Application in Sports Medicine: J Am Acad Orthop Surg. 2009 Oct;17(10):602–8.34
39. Dohan Ehrenfest DM, Rasmusson L, Albrektsson T. Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte- and platelet-rich fibrin (L-PRF). Trends Biotechnol. 2009 Mar;27(3):158–67.
40. Zhu Y, Yuan M, Meng HY, Wang AY, Guo QY, Wang Y, et al. Basic science and clinical application of platelet-rich plasma for cartilage defects and osteoarthritis: a review. Osteoarthritis Cartilage. 2013 Nov;21(11):1627–37.
41. Wang-Saegusa A, Cugat R, Ares O, Seijas R, Cuscó X, Garcia-Balletbó M. Infiltration of plasma rich in growth factors for osteoarthritis of the knee short-term effects on function and quality of life. Arch Orthop Trauma Surg. 2011 Mar;131(3):311–7.
42. Sampson S, Reed M, Silvers H, Meng M, Mandelbaum B. Injection of Platelet-Rich Plasma in Patients with Primary and Secondary Knee Osteoarthritis: A Pilot Study. Am J Phys Med Rehabil. 2010 Dec;89(12):961–9.
43. Hagerman GR, Atkins JW, Dillman CJ. Rehabilitation of chondral injuriesand chronic degenerative arthritis of the knee in the athlete. Oper Tech Sports Med. 1995 Apr 1;3(2):127–35.
44. Steadman JR, Rodkey WG, Singleton SB, Briggs KK. Microfracture technique forfull-thickness chondral defects: Technique and clinical results. Oper Tech Orthop. 1997 Oct;7(4):300–4.
45. Miller B, Steadman J, Briggs K, Rodrigo J, Rodkey W. Patient Satisfaction and Outcome After Microfracture of the Degenerative Knee. J Knee Surg. 2010 Jan 27;17(01):13–7.
46. Steadman JR, Briggs KK, Rodrigo JJ, Kocher MS, Gill TJ, Rodkey WG. Outcomes of microfracture for traumatic chondral defects of the knee: Average 11-year follow-up. Arthrosc J Arthrosc Relat Surg. 2003 May;19(5):477–84.
47. Frisbie DD, Trotter GW, Powers BE, Rodkey WG, Steadman JR, Howard RD, et al. Arthroscopic Subchondral Bone Plate Microfracture Technique Augments Healing of Large Chondral Defects in the Radial Carpal Bone and Medial Femoral Condyle of Horses. Vet Surg. 1999 Jul;28(4):242–55.35
48. Frisbie DD, Morisset S, Ho CP, Rodkey WG, Steadman JR, Mcllwraith CW. Effects of Calcified Cartilage on Healing of Chondral Defects Treated with Microfracture in Horses. Am J Sports Med. 2006 Nov;34(11):1824–31.
49. Frisbie DD, Oxford JT, Southwood L, Trotter GW, Rodkey WG, Steadman JR, et al. Early Events in Cartilage Repair After Subchondral Bone Microfracture: Clin Orthop. 2003 Feb;407:215–27.
50. Steadman JR, Rodkey WG, Briggs KK. Microfracture: Its History and Experience of the Developing Surgeon. CARTILAGE. 2010 Apr 1;1(2):78–86.
51. Steadman JR, Dragoo JL, Hines SL, Briggs KK. Arthroscopic Release for Symptomatic Scarring of the Anterior Interval of the Knee. Am J Sports Med. 2008 Sep;36(9):1763–9.
52. Robertson B. Microfracture Procedure of the Knee - Postoperative Rehab Protocol.
53. Crawford K, Philippon MJ, Sekiya JK, Rodkey WG, Steadman JR. Microfracture of the Hip in Athletes. Clin Sports Med. 2006 Apr;25(2):327–35.
54. Byrd JWT. HIP ARTHROSCOPY. Clin Sports Med. 2001 Oct;20(4):703–32.
55. Enseki KR, Martin RL, Draovitch P, Kelly BT, Philippon MJ, Schenker ML. The Hip Joint: Arthroscopic Procedures and Postoperative Rehabilitation. J Orthop Sports Phys Ther. 2006 Jul;36(7):516–25.
56. Monllau JC, Solano A, León A, Hinarejos P, Ballester J. Tomographic study of the arthroscopic approaches to the hip joint. Arthrosc J Arthrosc Relat Surg. 2003 Apr;19(4):368–72.
57. Horisberger M, Brunner A, Herzog RF. Arthroscopic Treatment of Femoroacetabular Impingement of the Hip: A New Technique to Access the Joint. Clin Orthop. 2010 Jan;468(1):182–90.
58. Robertson WJ, Kelly BT. The Safe Zone for Hip Arthroscopy: A Cadaveric Assessment of Central, Peripheral, and Lateral Compartment Portal Placement. Arthrosc J Arthrosc Relat Surg. 2008 Sep;24(9):1019–26.36
59. Yusaf MA, Hame SL. Arthroscopy of the Hip: Curr Sports Med Rep. 2008 Sep;7(5):269–74.
60. McCarthy JC, Lee JA. Arthroscopic Intervention in Early Hip Disease: Clin Orthop. 2004 Dec;429:157–62.
61. Medda S, Al’Khafaji IM, Scott AT. Ankle Arthroscopy With Microfracture for Osteochondral Defects of the Talus. Arthrosc Tech. 2017 Feb;6(1):e167–74.
62. Salata MJ, Kercher JS, Bajaj S, Verma NN, Cole BJ. Glenohumera Microfracture. CARTILAGE. 2010 Apr;1(2):121–6.
63. Weber AE, Locker PH, Mayer EN, Cvetanovich GL, Tilton AK, Erickson BJ, et al. Clinical Outcomes After Microfracture of the Knee: Midterm Follow-up. Orthop J Sports Med. 2018 Feb 1;6(2):232596711775357.
64. Philippon MJ, Schenker ML, Briggs KK, Kuppersmith DA, Maxwell RB, Stubbs AJ. Revision Hip Arthroscopy. Am J Sports Med. 2007 Nov;35(11):1918-21.
65. Blevins FT, Steadman JR, Rodrigo JJ, Silliman J. Treatment of Articular Cartilage Defects in Athletes: An Analysis of Functional Outcome and Lesion Appearance. Orthopedics. 1998 Jul;21(7):761–8.
66. Thomas Byrd JW, Jones KS. Hip Arthroscopy in Athletes: 10-Year Follow-Up. Am J Sports Med. 2009 Nov;37(11):2140–3.
67. Frank RM, Van Thiel GS, Slabaugh MA, Romeo AA, Cole BJ, Verma NN. Clinical Outcomes after Microfracture of the Glenohumeral Joint. Am J Sports Med. 2010 Apr;38(4):772–81.
68. Clanton T, Matheny L, Johnson N. Outcomes Following Ankle Microfracture Surgery. Arthrosc J Arthrosc Relat Surg. 2014 Jun;30(6):e27–8.
69. Chen H, Sun J, Hoemann CD, Lascau-Coman V, Ouyang W, McKee MD, et al. Drilling and microfracture lead to different bone structure and necrosis during bone-marrow stimulation for cartilage repair. J Orthop Res. 2009 Nov;27(11):1432–8.37
70. Chen H, Hoemann CD, Sun J, Chevrier A, McKee MD, Shive MS, et al. Depth of subchondral perforation influences the outcome of bone marrow stimulation cartilage repair: SURGICAL PARAMETERS IN BONE MARROW STIMULATION. J Orthop Res. 2011 Aug;29(8):1178–84.
71. Benthien JP, Behrens P. Reviewing subchondral cartilage surgery: considerations for standardised and outcome predictable cartilage remodelling: A technical note. Int Orthop. 2013 Nov;37(11):2139–45.
72. Zedde P, Cudoni S, Giachetti G, Manunta M, Masala G, Brunetti A, et al. Subchondral bone remodeling: comparing nanofracture with microfracture. Anovine in vivo study. Joints. 2016 Apr;04(02):087–93.
73. Liječenje oštećene zglobne hrskavice | Mislav Jelić [Internet]. 2017 [cited 2023 Jun 7]. Available from: https://mislavjelic.com/lijecenje-ostecene-zglobne-hrskavice/
74. Wasyłeczko M, Sikorska W, Chwojnowski A. Review of Synthetic and Hybrid Scaffolds in Cartilage Tissue Engineering. Membranes. 2020 Nov 17;10(11):348.
75. New Scaffolds & Cells | Patient Education [Internet]. [cited 2023 Jun 7]. Available from: https://cartilage.org/patient/about-cartilage/cartilage-repair/new-scaffolds-cells/
76. Ahmadian E, Eftekhari A, Janas D, Vahedi P. Nanofiber scaffolds based on extracellular matrix for articular cartilage engineering: A perspective. Nanotheranostics. 2023;7(1):61–9.













